君联医疗全球新药资讯速递第26期
君联医疗全球新药资讯速递第26期本周要点本周新药数据共8个,其中呼吸2个,皮肤2个,肿瘤、免疫、代谢和疼痛各1个。PD-1本周在国内迎来高光时刻,施贵宝O药获中国药监局首批用于治疗
本周要点
本周新药数据共8个,其中呼吸2个,皮肤2个,肿瘤、免疫、代谢和疼痛各1个。
PD-1本周在国内迎来高光时刻,施贵宝O药获中国药监局首批用于治疗头颈部鳞癌,至此已累计用于治疗7大癌种,与此同时默沙东K药获批单药用于国内肺癌一线治疗,解锁6大癌种。截至目前,国内已经有5个PD-1单抗批准上市,分别为施贵宝Opdivo、默沙东Keytruda、君实生物的拓益、信达生物的达博舒和恒瑞医药的艾瑞卡。从2019年上半年国内销售数据来看,默沙东Keytruda销售额超10亿元,列居榜首;而施贵宝Opdivo以4.3亿元被K药拉出两倍差距;国产PD-1君实生物的拓益 3.08亿元、信达生物的达博舒3.46亿元,也纷纷交出亮眼答卷;恒瑞艾瑞卡从6月开始加入战局,未来表现值得期待。
在免疫治疗领域,全球药王修美乐的蛋糕一直是各家关注的香饽饽,IL-17A抑制剂是其有力竞争替代。诺华Cosentyx(苏金单抗)与礼来Taltz作为 IL-17A抑制剂领域的先发者竞争相当激烈。在销售额方面,2019年上半年Taltz的销售额飙升至6.063亿美元,而Cosentyx的表现更加抢眼,同期销售额达到16.5亿美元。在适应症方面,上周诺华宣布Cosentyx在治疗非放射性轴性脊柱关节炎的3期临床试验中达到主要终点,或将迎来第四个适应症。按照Cosentyx强劲的发展势头,未来有可能会进一步侵蚀修美乐的市场。
药物研发动态
诺华Cosentyx达到3期临床终点,或将迎来第四项适应症
公司诺华宣布, Cosentyx在治疗非放射性轴性脊柱关节炎(nr-axSpA)的3期临床试验PREVENT中,达到试验的又一主要终点。
药物机理
Cosentyx是首个可以直接抑制IL-17A的全人源生物制剂。IL-17A是参与PsA、AS和银屑病的炎症产生及疾病进展的核心致病因子,在发病机制中发挥关键性作用。
入组标准与实验设计
为期2年的随机、双盲、含安慰剂对照组的3期临床研究,旨在评估Cosentyx在治疗nr-axSpA患者中的疗效和安全性。试验的主要终点是达到脊柱关节炎国际协会评定40(ASAS40)。
结果
此次宣布的最新数据进一步证明了Cosentyx在治疗强直性脊柱炎(AS)、银屑病关节炎(PsA),以及银屑病中的长期疗效和安全性。
“破发”糖尿病肾病!杨森卡格列净获FDA批准
公司强生集团旗下的杨森宣布,FDA批准钠-葡萄糖共转运蛋白2抑制剂卡格列净在患有糖尿病肾病和2型糖尿病的成年患者中,用于降低终末期肾病、肾功能下降、心血管死亡以及由于心力衰竭而住院的风险。
药物机理
卡格列净是一种SGLT2抑制剂,它通过抑制肾小管中表达的SGLT2的功能,减弱肾脏对葡萄糖的重吸收,增加尿液中对葡萄糖的排泄,从而帮助控制2型糖尿病患者的血糖水平。
入组标准与实验设计
一项专门检测SGLT2抑制剂对肾功能影响的临床试验。总计4401名处于2或3期慢性肾病的2型糖尿病患者接受了治疗。
结果
在中位随访期2.62年时,卡格列净组患者复合终点风险(包括血清肌酐翻倍,ESKD和肾死亡或心血管死亡)与对照组相比降低了30%,同时卡格列净组患者的主要心血管不良事件(MACE)风险降低了20%。
20年来急性治疗偏头痛首个重大创新!FDA批准礼来5-HT1F受体激动剂上市
公司礼来(Lilly)公司宣布,美国FDA批准该公司开发的Reyvow(lasmiditan)片剂上市,作为急性疗法治疗有先兆或无先兆成年偏头痛患者。这是20多年来,FDA批准急性治疗偏头痛的第一种新药物类型。
药物机理
Reyvow是FDA批准的首款血清素(5-HT)1F受体激动剂,是一种创新口服5-HT1F受体激动剂。它能够与5-HT1F受体以高亲和力相结合,不会激活5-HT1B受体,因此不会产生血管收缩效应。
入组标准与实验设计
随机双盲,含安慰剂对照的3期临床试验,3177名有偏头痛历史的患者参加临床试验。
结果
与安慰剂组相比,在服药2个小时后患者头痛完全消失的比例显著提高,Reyvow显著消除其它最困扰患者的偏头痛症状(恶心和声光敏感)。在对曲坦类药物反应不足的患者亚群中,也能够产生良好的效果。
BReyvow在3期临床试验中的2h后疗效结果
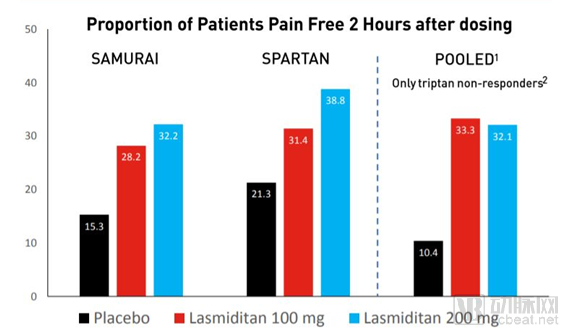
数据来源: 2018 Investment Community Meeting
哮喘患者闻佳音!诺华创新复方疗法达到3期临床终点
公司诺华(Novartis)公司宣布,该公司开发的复方疗法QVM149,在治疗症状控制不佳的哮喘患者的3期临床试验IRIDIUM中,达到主要临床终点。
药物机理
QVM149是一款每日一次、固定剂量的复方产品,由长效毒蕈碱拮抗剂(格隆溴铵)、长效β2受体激动剂(茚达特罗)和吸入皮质类固醇(糠酸莫米松)三种有效成分构成。
入组标准与实验设计
3092名哮喘控制不佳的成年患者随机接受两种不同剂量的QVM149或QMF149的治疗,都曾接受过中/高稳定剂量的长效β2受体激动剂/皮质类固醇的治疗,但症状仍未得到有效控制。
结果
与活性对照组相比,QVM149不仅显著改善患者的肺功能,还改善了患者的1秒用力呼气量(FEV1),达到了试验的主要终点,但未能达到试验的关键性次要终点。
苦盼二十载!粉刺创新疗法喜获FDA批准
公司高德美(Galderma)公司宣布,美国FDA批准其视黄酸受体γ(RARγ)激动剂Aklief(trifarotene)软膏上市,治疗9岁及以上寻常痤疮(acne vulgaris)患者。
药物机理
Aklief是一种选择性视黄酸受体γ激动剂,临床前数据表明,Aklief在角质形成细胞中具有较长的半衰期,但是在肝细胞中的半衰期较短,因此可能在治疗常见皮肤病的同时,具有更好的安全性。
入组标准与实验设计
为期12周、随机、双盲的3期试验,主要终点是,在第12周,患者较基线时达到研究者总体评估总分(IGA)2分以上的改善的成功率,面部炎症的改善,以及非炎症病变计数的减少。
结果
Aklief软膏可在两周内显著减少患者的炎症性病变。这两项试验的详细结果已经在Journal of the American Academy of Dermatology期刊上发表。
首页 下一页 上一页 尾页-
5G智慧医疗 助力健康扶贫2019-10-15
-
InterSystems与浪潮集团签署合作协议,共创健康医疗大数据平台和应用服务2019-10-15
-
AI用于疾病诊断和新药品设计的前景可观2019-10-14
-
Rock Health 2019Q3投融资报告:数字医疗完成融资13亿美金,行为健康和女性健康成亮点2019-10-14
-
智慧医疗时代跨国药企迎来新机遇2019-10-14
-
立达融医完成数千万A轮融资 ,持续加大医疗智能技术研发投入2019-10-13
-
药品信息化追溯体系正在加码,从0到1的体系建设带来这三大趋势2019-10-12
-
当AI+医疗走出医院 解读未来健康管理的无限可能2019-10-12
-
国家卫健委:我国医疗质量水平持续改善2019-10-12
-
腾讯8篇论文入选MICCAI2019 AI与医疗越走越近2019-10-12
-
医疗机构须先健康起来2019-10-12
-
乐普小蓝点体温计准不准?乐普智能医疗带来最佳产品2019-10-09
-
君联医疗全球新药资讯速递第25期2019-10-09
-
强生医疗DePuy Synthes推出新3D打印椎间融合器产品2019-10-09
-
电子病历带动百亿增量,千万级订单陡增,医疗信息化总包模式下的逆风翻盘!2019-10-09