AI+新药领域融资总额已超45亿美元
AI+新药领域融资总额已超45亿美元医药行业一直以来都是个相对封闭的行业。复杂且与其他行业不共通的药学知识,让医药行业与外界之间始终隔着一道墙。如今这堵墙正在因为数字化技术的介入逐
医药行业一直以来都是个相对封闭的行业。复杂且与其他行业不共通的药学知识,让医药行业与外界之间始终隔着一道墙。如今这堵墙正在因为数字化技术的介入逐渐瓦解。越来越多人工智能企业,开始与药物研发者们合作,将人工智能技术应用于新药研发的各个环节中,加速新药研发流程。
人工智能技术将如何改变新药研发行业?谁已经走到行业头部,谁又给出了全新的解决方案?
动脉网近期策划“AI新药研发”系列专题,厘清AI新药研发的行业格局与发展脉络,试图解码产业未来的发展方向。
近期,AI+新药市场频频传来捷报,多家企业在2020年完成了高额融资。
2020年9月,AI驱动药物研发公司晶泰科技宣布超额完成3.188亿美元C轮融资,创下全球AI药物研发领域融资额的最高纪录。同月,AI临床阶段药物研发公司Recursion Pharmaceuticals也完成了2.39亿美元D轮融资。将时间再往前推进一个月,2020年8月,又一AI驱动药物研发公司星药科技宣布完成1000万美元PreA轮融资。
医药研发是制药企业价值和生命力的核心所在,但新药研发周期长、成功率低和研发费用高一直是该领域内的三大困境。以深度学习为代表的人工智能技术,凭借其强大的发现关系能力和计算能力加速医药研发,掀起了AI+新药的热潮,不仅诞生了众多AI+新药企业,还有促进了传统制药巨头在AI+新药领域的探索。
2020年6月,Drug Discovery Today期刊发表了一篇短文综述《The upside of being a digital pharma player》,文章分析了2014年到2018年,全球21家制药巨头研发部门中AI应用的现状。结果表明,AI+新药领域尽管仍处于早期,但已经趋于成熟。该文章分析了各大制药巨头的收益和研究投入,发现仅赛诺菲和吉利德两家企业的投入大于收益,阿斯利康和诺华两家企业则是收益远远大于研究投入的代表。
动脉网据公开资料统计,截止到2020年10月16日,海内外共有56家AI+新药企业共获得融资,累计获得融资总额共计45.81亿美元。其中,国外有37家公司获得融资,累计总额共计31.65美元,国内有19家公司获得融资,累计融资总额14.16亿美元。
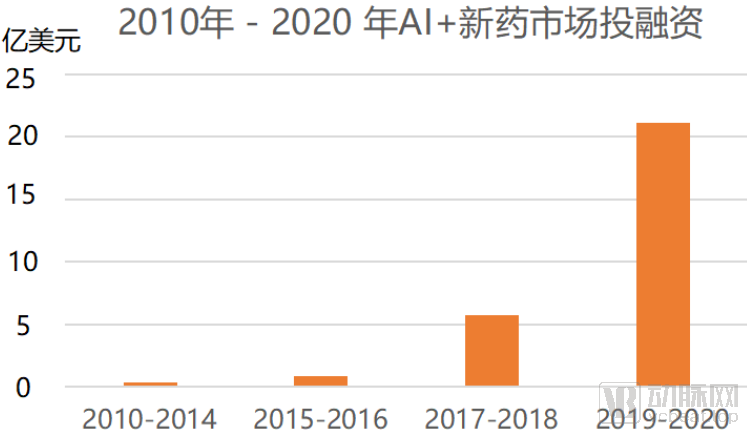
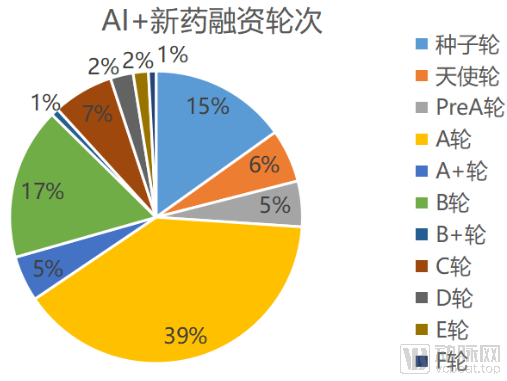
AI+新药研发市场从2010年到2020年,获得融资金额逐年上升,二级市场活跃,动脉网对56家AI+新药研发企业进行梳理发现,目前仅有三家企业(BioXcel Therapeutics、IQVIA、Schrodinger)上市,AI+新药研发目前正处于成熟的起步阶段。
AI将为药企带来怎样的突破?AI+新药研发的应用场景发展现状如何?头部企业为何受到资本青睐?
AI突破新药研发困境,数字化医药时代已经到来
随着世界各国经济的发展以及人民生活水平的提高,全球医疗支出不断增加,制药工业的发展得到了极大地提升,医药行业市场规模日益扩大。
2017年全球医药市场销售额已经突破12000亿美元,预计到2021年销售总额可达到14750亿美元,2012~2021年的年均复合增长率为4.9%。
而同时期中国医药市场的销售额将从2012年的770亿美元增长到2021年的1780亿美元,年均复合增长率达到9.8%,是全球医药市场的2倍。这表明全球医药市场在稳步增长,而中国医药市场的增长更快,具备更好的发展潜力。
中国的医药市场位于世界第二大市场,在市场驱动力的高速增长下,我国医药市场在过去几年保持着超过全球医药市场的增速增长。数据显示,2019年中国医药市场规模为16330亿元,预计2020年将进一步扩大至17147亿元。医药市场稳步增长,药企更加需要加大新药研发力度来满足市场的需求。
新药研发主要包括药物发现、临床前研究、临床研究以及审批与上市四个阶段。
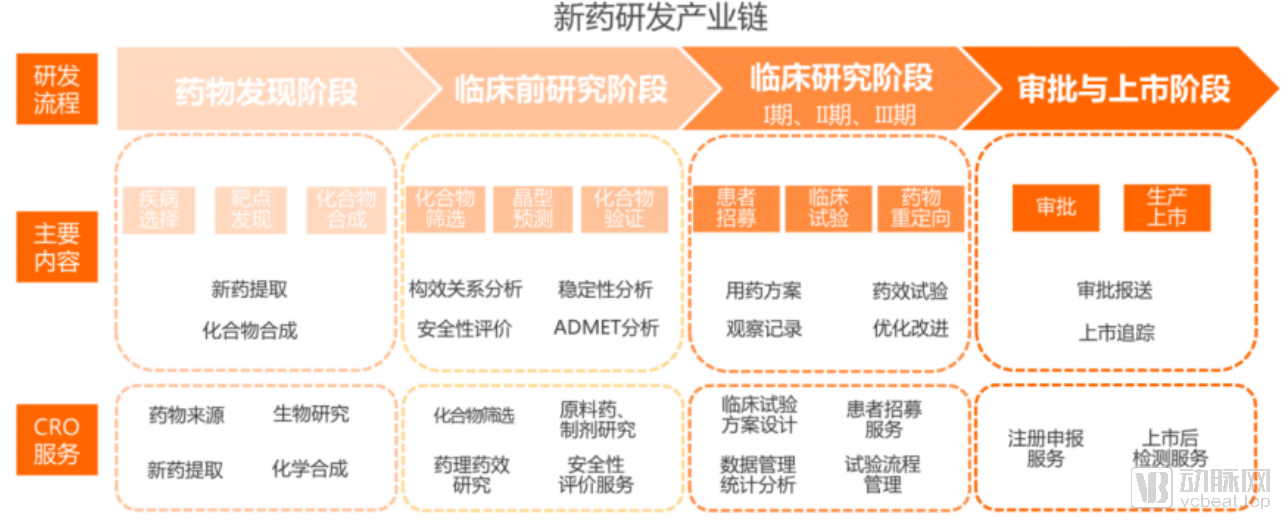
其中,药物发现阶段主要涉及疾病选择、靶点发现和化合物合成。而临床前研究阶段则以化合物筛选、晶型预测、化合物验证为主,包括药物的构效关系分析、稳定性分析、安全性评价和ADMET分析等。
药物发现阶段和临床前研究阶段是药企亟待攻关的两大难点,新药研发面临研发周期长、研发成功率低以及研发费用高等三大困境。
药物研发,越往后成本越高,但如毒性、溶解度等对药物成败起关键作用的性质要在相对后期才能进行实验研究。因此,传统方法,往往在投入了大量的时间、人力、金钱成本进行研发推进后才发现一个药物候选并不适合成药,这就造成很多资源和机会上的浪费。
各大传统药企在面临研发周期长、研发成功率低以及研发费用高的困境下,都在努力尝试通过技术创新来加快新药研发速度、提高成功率和降低成本,以能更好地满足日益增长的用药需求。这为AI技术在新药研发领域的应用带来了契机。
AI主要应用其强大的发现关系能力和计算能力助力新药研发。
在发现关系方面,AI具备自然语言处理、图像识别、机器学习和深度学习能力,可以快速发现药物和疾病、基因之间的链接关系。
在计算方面,AI具备的强大认知计算能力,可以对候选化合物进行虚拟筛选,更快的筛选出具有较高活性的化合物,为后期临床试验做准备。
AI+新药应用场景:靶点发现先行,化合物筛选紧跟其后
机器学习的算法可以被大致分为两类:监督学习和非监督学习。其中监督学习方法主要用于建立训练模型,借助数据回归分析方法和分类器方法,对数据类别或连续变量进行结果预测。而非监督学习则是用于建立一个开发模型,对含有相同特性的静态数据进行聚类。
将这两种方法应用到新药研发中,非监督学习主要针对的是将海量医学临床前和临床数据进行分类,例如单细胞RNA数据进行细胞类型和生物标志物分类、对生物标志物进行更深层次特征的筛选、低剂量CT数据分析等。
和非监督学习相比,监督学习方法算法更多,应用范围更加广泛。
分类器方法可以从海量文献中挖掘靶点-疾病-基因关系,从基因表达特征中寻找组织特异性的生物标志物。回归分析方法可以量化分析分子的构效关系,预测成功临床试验的基因表达特征和药物敏感性等。在监督学习方法里,将数据回归分析方法和分类器方法进行结合,可以进行虚拟的药物靶标筛查实验,从而输出待测化合物的生物活性和检测结果。
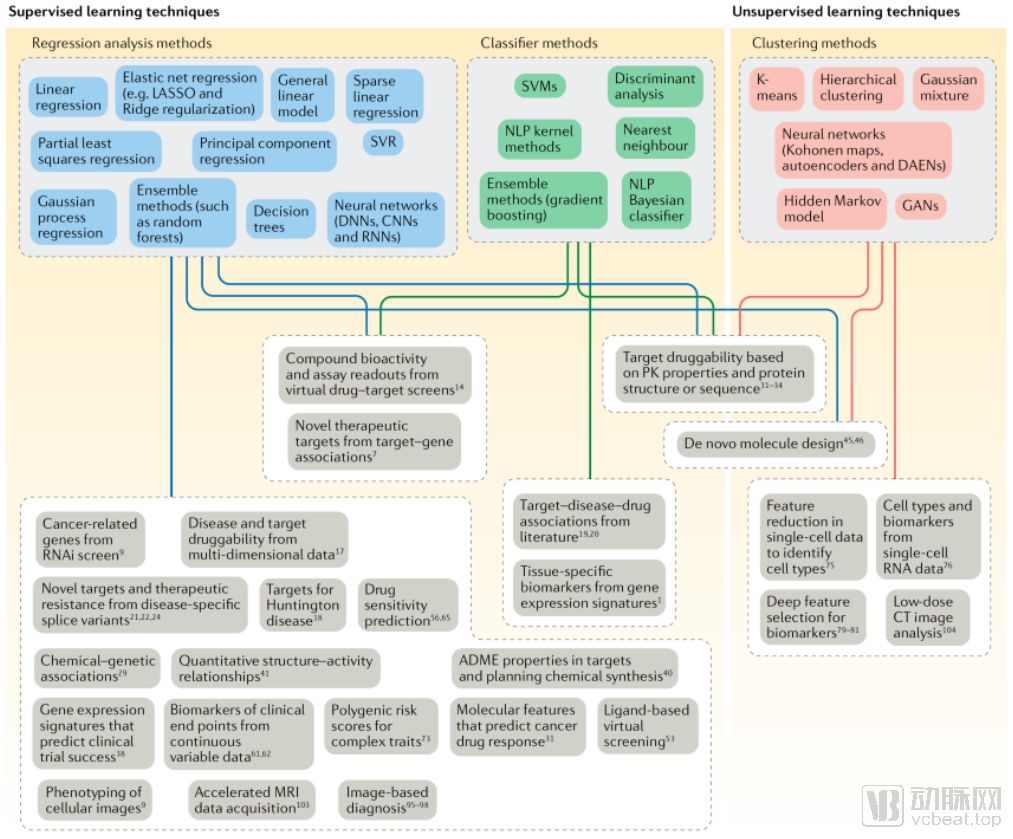
监督学习和非监督学习算法总结及其应用,来源:Nature Review Drug Discovery
此前蛋壳研究院据公开资料整理,将AI在新药研发领域的主要应用分为以下七大场景:靶点发现、化合物合成、化合物筛选、晶型预测、患者招募、优化临床试验设计和药物重定向。
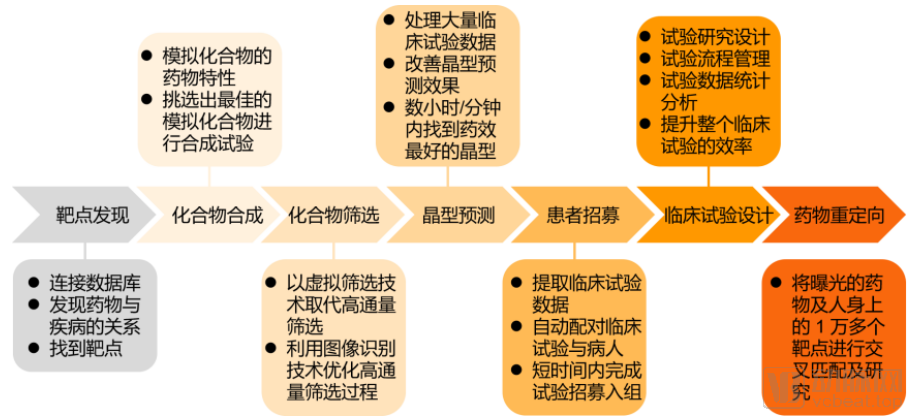
AI+新药应用七大场景
非监督学习在健康数据的聚类上有突出优势,更加贴近患者招募和优化临床试验设计等应用场景,但其目前的算法种类仅存在五种,与监督学习相比还有很大的进步空间。监督学习覆盖了靶点发现、化合物筛选、药物重定向等AI+新药应用场景,这也是为什么目前以靶点发现和化合物筛选为重点的AI+新药应用发展最快,并且在多家头部企业开展业务中均有体现。
动脉网将截止到2020年10月9日的AI+新药企业投融资事件进行分析发现,目前海内外融资总额排名前十的AI+新药企业在七大应用场景有自己涉猎的重点,其中化合物筛选是众多公司的优先选择,7家头部企业均开设相关研发管线。紧跟其后的则是靶点发现,共有6家企业有突破性进展。临床试验设计仅有一家TOP10企业开展相关业务。
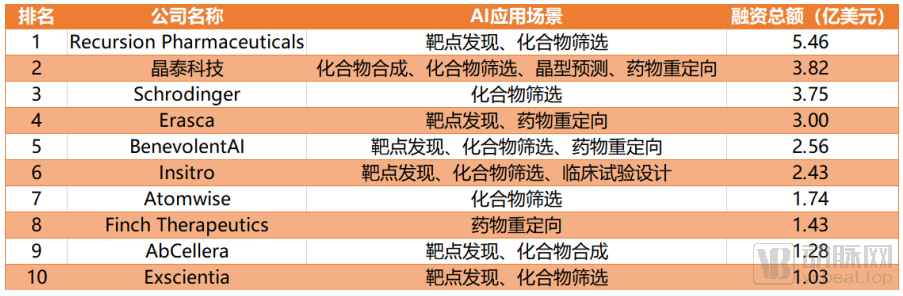
AI+新药研发企业融资总额TOP10
1
靶点发现
新药发现中基于药物靶点的药效学评价已经成为当今国内外新药研究和开发的基本方针。当药物靶点确定之后,就要开展基于靶点的药效学评价,从而发现新药。传统的靶点研究依赖药学研究工作者对相关科研文献和个人知识经验积累去推测靶点,平均耗时在2~3年的时间,并且发现靶点的成功率极低。
药物靶点的发现核心是要从海量数据库中获得靶点和疾病之间的因果关系,机器学习可以提供一系列工具,通过使用大量的高质量生物数据和算法对计算机进行训练,使计算机能够学习如何执行任务,对指定问题进行发现和决策,由此诞生了目前最活跃的AI+新药研发应用场景。
生物学数据的不断丰富为靶点发现研究创造了资源积累。现代生物学数据,包含了大批量人群中的人类遗传信息、健康个体和患有特定疾病个体的转录组学信息、蛋白组学信息和代谢组学信息,以及大量的临床影像资料。这些多维度的高质量数据集在适当的分析方法下进行重新的组合,产生具有有效统计的模型,这样的模型就是靶点发现的核心所在,它可以对靶点识别作出预测,缩短靶点发现周期。
随着机器学习算法的不断发展和数据质量和范围的提高,目前机器学习已经能够从人类健康相关的图像、文本、生物识别信息和其他来自可穿戴设备、试验数据及高纬度的生物组学数据获取目标内容,并进行分析整理。
2
化合物筛选
当靶点大分子确定后,可以找到大量潜在分子和该靶点产生相互作用,药物研发的下一步就是对潜在药物分子的安全性进行有效判断,筛选得到低副作用的潜在药物分子,从而进行后续临床研究。
一种潜在的药物分子需要经过数年才能完成开发阶段和临床阶段试验,而且大多数化合物往往在进入市场之前就已经失败了。传统的新药研发,研究者利用高通量筛选从成千上万的候选化合物中识别出高潜力化合物,会消耗大量的时间和资源,而当候选分子的作用靶点极少时,消耗又会进一步加大。
为了解决这一问题,许多研究人员选择用虚拟筛查(Virtual Screening, VS)来辅助高通量筛查,通过更加快速和廉价的虚拟筛选方式,减少进入高通量筛选的先导化合物数量,从而大大提高高通量筛选的产率。
AI+新药融资总额TOP10企业梳理
为更加直观地体现头部企业在AI+新药研发相关环节的应用和业务,我们对这十家最受资本青睐的公司进行简单的梳理,主要涉及企业的概况介绍、主要产品以及企业的融资情况。
Exscientia
Exscientia搭建了人工智能平台进行自动化药物研发指导,主要应用场景为靶点发现和化合物筛选。
Exscientia利用组合算法对根据已有的药物研发数据自动设计出上百万种与特定靶标相关的小分子化合物(包括针对单靶点的小分子药物以及针对靶点组合的双特异性小分子药物),并根据药效、选择性、ADME(机体对外源化学物的吸收)等其他条件对化合物进行评估和筛选。而后筛选出来的化合物会被合成并且进行实验检测,然后实验数据会被反馈到AI系统中用于改善下一轮化合物的选择。Exscientia组合算法的优势可将药物研发时间从4.5年降低至1年,并且能够有效减少前期需要考虑的化合物数量。
Exscientia与制药巨头赛诺菲和住友制药展开合作,分别研发出两款双特异性小分子,充分验证了CENTAUR BIOLOGIST策略的可行性。截止到目前,Exscientia完成融资总额达1.03亿美元。
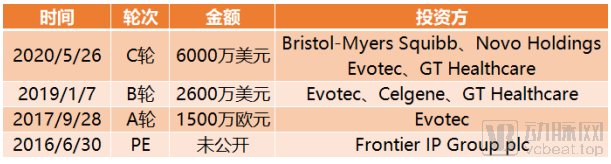
Exscientia融资
AbCellera
AbCellera是一家AI驱动的抗体研发公司,主要应用场景为靶点发现和化合物筛选。
公司拥有独家药物发现平台,该平台可以搜索和分析天然免疫系统,从而找到可用于预防和治疗疾病的抗体。AbCellera将高通量微流控、机器视图和人工智能相结合,从并行运算的高通量单个细胞分析中发现新的抗体分子疗法,加快抗体药物研发。
AbCellera的核心技术是高通量微流控平台,该平台通过使用微型化分析来自任何物种的单个B细胞,从而筛选出候选抗体药物。该平台可以根据疾病类型和应用目标进行个性化定制,在筛选出来的备选抗体中还可以进一步进行结构优化和来源优化。AbCellera的平台可以筛选一次运动中的数百万个细胞,诞生数百种治疗候药物。

AbCellera抗体筛选流程,来源:AbCellera官网
AbCellera利用其人工智能技术平台,借助真实世界研究的优势,仅在对患者血液样本进行第一次筛查的3个月之后,就帮助全球第一个COVID-19抗体候选药物成功进入人体临床试。AbCellera已经建立了一个完整的技术站来搜索、解码和分析天然免疫系统,找到最好的候选抗体并将其发展成药。
截止到目前,AbCellera完成融资总额达1.28亿美元。
AbCellera融资历程
Finch Therapeutics
Finch Therapeutics成立于2004年,是一家AI驱动的微生物疗法研发公司,主要应用场景为药物重定向。
公司采用创新的机器学习算法,基于高通量微生物分子数据,反向分析推导构建成功的临床微生物疗法,这类创新疗法是以粪便移植科学为基础的。Finch使用这种以人体为先的微生物学方法,来鉴定和开发具有临床收益的菌株,并将这些微生物群落输入给患者。
HUMAN-FIRST DISCOVERY?是Finch的核心平台,利用人类小型生物群移植临床研究数据和机器学习平台,找到成功应用在患者疾病治疗的微生物群体。Finch目前开设两大研发管线,Full-Spectrum Microbiota和Rationally-Selected Microbiota,分别应对广谱性和特异性的微生物疗法。
Full-Spectrum Microbiota将健康捐赠者群体按照规则进行严格筛选,将捐赠者体内具备多样性的微生物群体筛选并收集,以GMP标准制成药物,保护了微生物群体的完整性,使其维持微生物多样性和功能。Rationally-Selected Microbiota为可在纯培养基中生长繁殖的微生物菌群设计靶向机制,得到精选微生物菌株。
截止到目前,Finch Therapeutics完成融资总额达1.43亿美元。
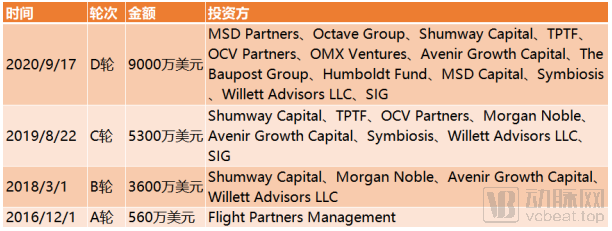
Finch Therapeutics融资历程
Atomwise
Atomwise是一家利用超级计算机进行药品研发的公司,主要应用场景为化合物筛选。
该公司旨在运用超级计算机、AI和复杂的算法模拟制药过程,来预测新药品的效果,降低研发成本。
Atomwise 公司开发的 AtomNet 化合物筛选系统,是一款基于卷积神经网络的AI系统,旨在运用超级计算能力和复杂的算法,对潜在药物分子的多向药理学、选择性和疗效等性质进行筛选,同时保证其低脱靶效应。AtomNet可以自主地学习控制分子结合的特性,避免了传统计算方法中典型的手工调整和参数化结合特性的过程。AtomNet将局部卷积滤波器应用于蛋白质结构目标信息,能够成功预测目标的新活性分子。
AtomNet将对新药的发现和优化从数年的时间缩短到数周,大大降低了时间和资源成本,为制药公司、创业公司和研究机构带来更多的发展机会。目前AtomNet已经将化合物发现效率提高1万倍,筛选结果输出速率比超高通量筛选高出100倍,每天可筛选超过1亿个化合物分子。
截止到目前,Atomwise完成融资总额达1.74亿美元。
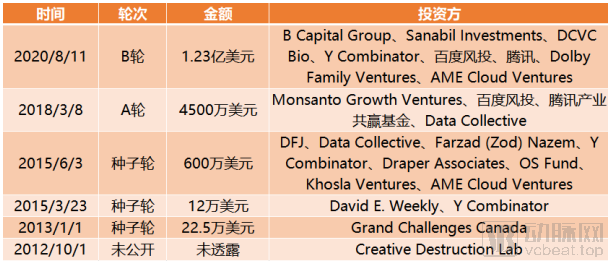
Atomwise融资历程,来源:动脉橙
Insitro
Insitro是一家以机器学习和高通量生物学为核心的药物研发公司,主要应用场景为靶点发现、化合物筛选、临床试验设计。
Insitro不仅依靠有限的“已找到”数据,而且可以利用现代生物学工具来生成针对机器学习进行了优化的高质量大数据集,通过生成与患者数据一致的高通量功能基因组数据集,并通过新颖的机器学习方法来解释这些数据,从而建立用于加速靶点筛选和推动治疗方案设计的预测模型。
Insitro通过从遗传、表型和临床数据中获取相关信息,利用机器算法来提高传统遗传分析的精准度,使之更接近疾病的基本结构和生物学,数据管道和自动化设施可以快速生成大量高质量的数据。同时,Insitro结合了来自患者的诱导多能干细胞(iPSCs)、基因组编辑、高含量细胞表型和机器学习等方式来构建体外疾病模型,通过优化遗传、细胞类型、环境和多维数据收集,可以用更细的粒度区分细胞状态,并预测与疾病相关的临床特征,最大限度地预测药物临床结果。
Insitro疾病预测模型结合了体外细胞系统和计算机模拟机器学习,可以发现以前从未见过的疾病类型,并寻找其治疗手段。通过预测模型,Insitro能够识别疾病的突破性靶点,使药物设计具有可行性,并推动生物标志物和临床开发策略的发展。
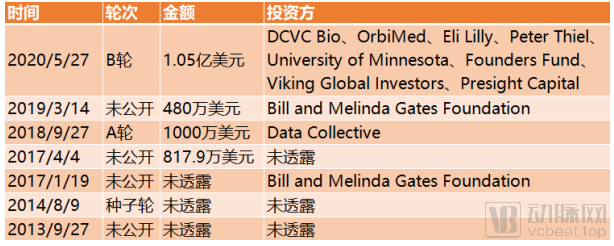
截止到目前,Insitro完成融资总额达2.43亿美元。
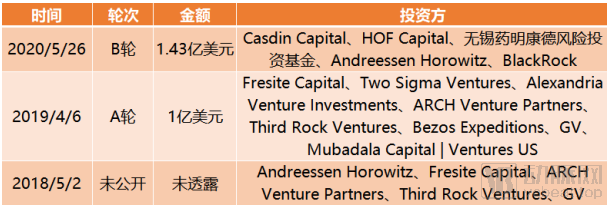
Insitro融资历程,来源:动脉橙
BenevolentAI
BenevolentAI是一家应用人工智能开发治疗疑难疾病新药公司,它是第一家完全集成的AI公司,同时拥有药物发现和临床开发能力,主要的应用场景是靶点发现、化合物筛选、药物重定向。
BenevolentAI核心技术平台为JACS(Judgment Augmented Cognition System),是一种判断加强认知系统,从散乱无章的海量信息中提取出能够推动药物研发的知识,提出新的可以被验证的假设,从而加速药物研发的过程。
为提高JACS运算能力,公司从英伟达购买了专门为深度学习设计的超级计算机DGX-1。这台计算机可以模拟发生在大脑皮层中的识别和学习模式,加快在不同信息源之间建立新的关系,从而产生更快、更多的新药创新。
一种疾病在多个患者群中的致病机制是不同的,但有效的治疗需要将这些不同的机制逐一击破。公司的目标在于希望通过AI平台来识别这些机制的药物靶标,并让药物作用于它们。
BenevolentAI公司推出的JACS系统,凭借其自然语言处理能力和深度学习能力,在短时间内能够集中处理大量的非结构化数据,包括疾病数据、药物数据、试验数据等等,并发现他们之间的新联系,找到药物的新适应症,实现药物重定向,帮助科学家发现药物更有价值的适应症。
2014年6月,BenevolentAI宣布与一家美国的制药公司达成合作,并将两款经过新适应症(阿尔茨海默氏症)验证的新药卖给这家美国公司,这两款药物处于中标候选化合物评估阶段,此次交易高达8亿美。2017年5月,BenevolentAI对一款名为bavisant的临床试验失败药物进行重定向分析,发现其对帕金森患者日间过渡嗜睡症状具有较好的治疗效果。
截止到目前,BenevolentAI 完成融资总额达2.56亿美元。
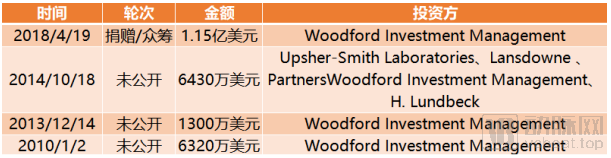
BenevolentAI融资历程
Erasca
Erasca公司成立于2018年,是一家专注于消除癌症的生物技术公司,主要应用场景为靶点发现和药物重定向。
Erasca有多个发现项目正在进行中,针对的是未公开的靶点,这些靶点是癌症的生物学驱动因素。
OPRA(oncology Pattern Recognition Algorithm)是Erasca的专有人工智能药物发现平台,利用机器学习等先进的计算工具,开发创新的肿瘤治疗策略。该平台不依赖于某种特定的药物或任何关于癌症治疗的单一方法,以单剂联合方法关闭癌症通路,从而加速药物发现。OPRA通过分析国内外大规模数据集,使Erasca的科学家能在庞大的癌症生物学数据中处理基本致癌基因。
OPRA的数据医疗方法非常灵活,支持多个程序并行部署。OPRA还运用Erasca的药物发现流程,使科学家和人工智能在研发过程中加速开发具有最大效力的疗法,以实现其治愈癌症的最终目标。
截止到目前,Erasca完成融资总额达3.00亿美元。
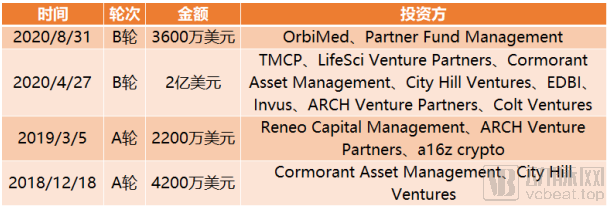
Erasca融资历程
Schrodinger
薛定谔公司是一家药物发现与材料设计公司,致力于开发和应用先进的计算方法,改变科学家设计治疗方法和材料的方式,主要应用场景为化合物筛选。
FEP是薛定谔推出的药物研发解决方案,它以“自由能扰动”方法为基础,持续高精度地评估所有环节的物理作用对药物分子与蛋白质结合的贡献。其中,自由能扰动是指将一个初始分子扰动或转化为另一个目标分子,通过评估自由能扰动带来的结合亲和力变动,确定分子的蛋白质结合亲合力。
在FEP+中,薛定谔公司在GPU上运行具有计算效率的分子动力学引擎,并整合经典分子力学力场、自动化工作流程,采用高效,增强的采样方法,实现自动原子映射和交互映射分配,以确保自由能量扰动评估的准确性。
利用其计算平台,它每周都可以评估数十亿种化合物分子。而利用常规的方法,普通的医药公司每年大约能在药物发现项目中合成1000个候选化合物。
截止到目前,薛定谔完成融资总额达3.75亿美元。薛定谔也是融资总额排名前十内唯一一家上市公司,上市当日募资逾2亿美元,超过预期募资33%。
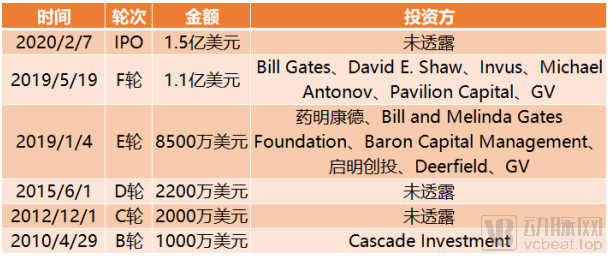
Schrodinger融资历程
晶泰科技
晶泰科技成立于2015年09月11日,是一家以计算驱动创新的药物研发公司,主要应用场景是化合物合成、化合物筛选、晶型预测及药物重定向。
公司以计算驱动创新,其ID4(Intelligent Digital Drug Discovery and Development)智能药物研发平台结合量子物理、人工智能与超大规模云计算技术,可以准确预测小分子药物的多种重要特性,加速药物临床前研究的效率与成功率。
晶泰科技突破性地实现对小分子药物重要特性的快速、准确预测,药物晶型预测技术已达到世界领先水平,在体系复杂度、预测精确度与计算速度上远超同类预测方法。在药物设计和药物固相筛选等领域拥有多项行业领先的技术,目前,药物晶型预测技术已被全球多家药企采用,获得业界专家的广泛认可。
截止到目前,晶泰科技完成融资总额达3.82亿美元。
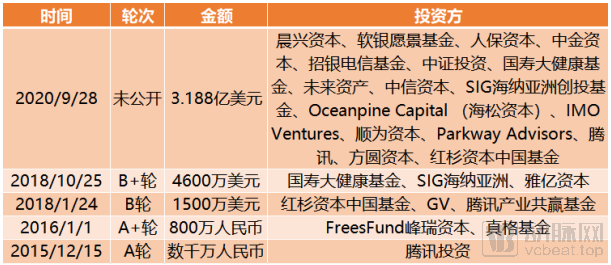
晶泰科技融资历程
Recursion Pharmaceuticals
Recursion Pharmaceuticals是一家是一家集人工智能、实验生物学和自动化于一体的临床阶段生物技术公司,主要应用场景为靶点发现、化合物筛选、临床试验设计。
Recursion将实验生物学和自动化与人工智能结合在一个大规模并行系统中,有效地发现各种适应症的潜在药物,包括遗传病、炎症、免疫学和传染病等疾病。
Recursion的机器人平台拥有丰富的、可关联的数据库,其中包含超过2PB的生物图像,这使得该公司的机器学习方法能够揭示候选药物作用机制和潜在的毒性,解码生物学,并推进新的疗法,从根本上改善人们的生活。
虽然Recursion计划优先发展其自身的罕见疾病治疗业务,但它将继续在多个疾病领域,包括免疫肿瘤学、肿瘤学、衰老和炎症等,与业界领先的制药公司建立合作关系。
截止到目前,Recursion Pharmaceuticals完成融资总额达5.46亿美元,是目前获得融资总额最高的AI+新药公司。
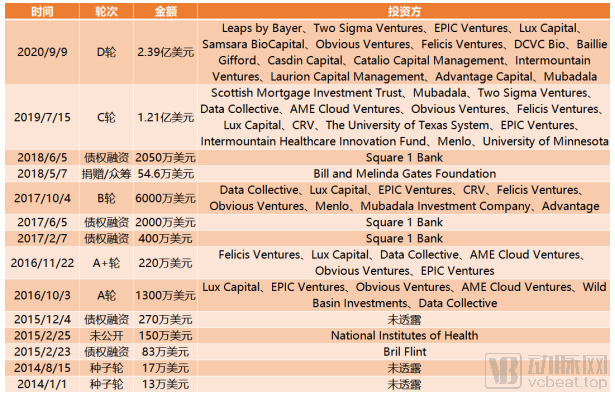
Recursion Pharmaceuticals融资历程
作者:唐巧
上一篇:摄糖太积极,健康有问题
-
FDA批准首个新冠药物瑞德西韦,吉利德盘后涨近4%2020-10-23
-
对抗致死率90%的埃博拉病毒 全球首款治疗药物获批2020-10-19
-
首款埃博拉治疗药物!再生元中和抗体组合疗法Inmazeb获批上市2020-10-16
-
志道完成亿元融资,推进细胞因子药物临床开发2020-10-16
-
电子血管:促进血液流动,协助药物输送2020-10-04
-
药物如何精准命中癌细胞?2020-10-03
-
新通药物完成Pre-IPO轮逾亿元人民币融资2020-09-19
-
塔吉瑞完成近亿元战略融资,研究开发最新一代靶向药物2020-09-19
-
Dogma科学家团队致力于研发出一种方便供口服的PCSK9药物2020-09-18
-
以毒攻毒!蜜蜂毒素只需60分钟即可100%杀死乳腺癌细胞,与化疗药物联用效果更佳2020-09-14
-
Exscientia与华东医药建立合作开发伙伴关系 加速抗肿瘤药物研发2020-09-13
-
Exscientia与华东医药将合作研发加速抗肿瘤药物2020-09-12
-
科凝生物:两大眼部药物递送系统,革新眼科现有标准疗法2020-09-08
-
哪些常用药物会增加阿尔茨海默病的风险?2020-09-06
-
专注于罕见病药物,北海康成获新一轮融资2020-09-05