新冠特效药研发能不能创造火神山奇迹?
新冠特效药研发能不能创造火神山奇迹?本文由“苏宁财富资讯”原创,作者为苏宁金融研究院高级研究员陈嘉宁。2020年的春天来得并不轻松,一场突如其来的传染病毒,打乱了人们正常的生活节奏
本文由“苏宁财富资讯”原创,作者为苏宁金融研究院高级研究员陈嘉宁。
2020年的春天来得并不轻松,一场突如其来的传染病毒,打乱了人们正常的生活节奏。慌乱中,人们在期待特效药和疫苗的问世。
而根据中国临床试验注册中心的数据,截至2月15日,全国范围内,共有117个针对新冠肺炎的药物和治疗方法的研究项目处于申报状态。其中,仅2月14日一天,申请进入临床实验的新冠肺炎用药研究项目就有17个。
以下是部分在研的新冠肺炎药物的汇总:
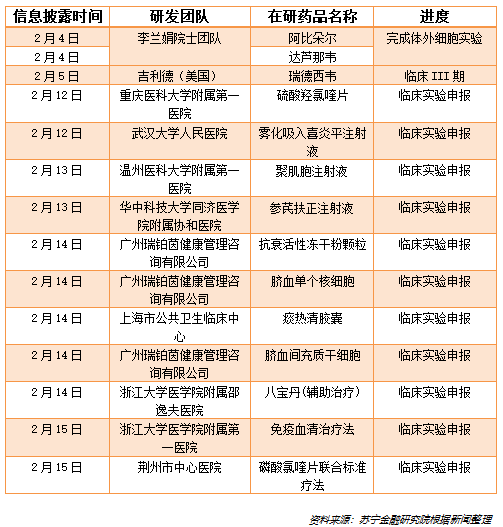
在疫苗方面,国内外也有二十余个机构和团队,在与时间赛跑。

新药研发的基本步骤有哪些?
见证了火神山医院、雷神山医院从一片荒地到迅速完工交付的“中国速度”,或许有人会在心中默念:新药研发“快一点,再快一点”,最好能够像火神山、雷神山一样,十余天时间创造奇迹。
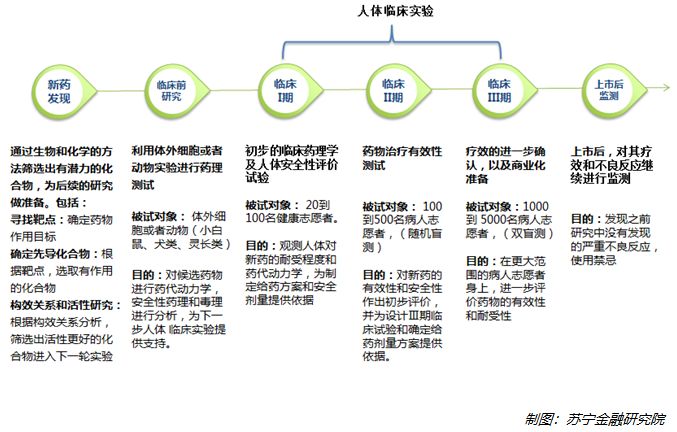
然而,只有当你了解了新药研发的过程,才能够理解科研机构的不易。新药研发的基本流程,如下图所示:
因为事关大量用药患者的健康和生命安全,任何药物在正式上市前都要经过一系列科学而谨慎的评估过程,在保证安全性和有效性的前提下,才有资格获批进入临床一线。
整个新药的研发和评估过程,通常包括以下六个步骤:
1、新药发现。该步骤主要是确定药物攻击方向(专业术语:寻找靶点),攻击目标可能是病原体在复制过程中不可或缺的一种酶,或者是特有的一段DNA片段,一旦靶点被药物所破坏,病原体即有望被抑制和清除。
根据靶点特点,生化学家会筛选出一系列活性好、有效果、安全性高的候选化合物进入下一步实验环节。
2、临床前研究。该步骤主要是在人体实验前,通过体外细胞实验,或者动物实验来对第一步筛选出来的候选化合物,进行药理测试。为了更好的在实验成本与接近人体环境之间平衡,实验动物也会不断升级,一开始可能用小白鼠实验,然后可能扩展到犬类,以及和人类更相近的灵长类动物。
通过动物实验,候选化合物的药代动力学反应、药理和毒理得到全面的评估,其中,一些有潜力的候选药物才有机会进入下一轮人体实验。
根据前面的信息,中国疾控中心和香港大学医学院各自研发的新冠疫苗产品就处在“动物实验”这个阶段。李兰娟院士团队提出的特效药“阿比朵尔”和“达芦那韦”也于2月4日完成了这个阶段的实验(通过体外细胞实验,证明能有效抑制冠状病毒),估计后面将开启人体实验。
3、临床I期实验(安全性测试)。人体实验的第一个阶段,该阶段重点是测试药物对人体的安全性。被试对象一般为20到100名健康的志愿者。通过观察这些志愿者对于不同剂量药物的耐受程度和药代动力学反应,为将来制定给药方案和安全剂量提供依据。
由于I期实验中的药物属于首次应用于人体,而且在给药的安全剂量、过敏反应也尚待研究,实验是存在一定的危险性的。因此,此类实验一般安排在有临床实验资质的三甲医院,且受到伦理委员会的监督。试验中心对于被试对象全程监控、及时救治,还会给予试药人一笔不菲的经济报酬。
只有通过临床I期实验,验证了药物的安全性,才有机会进入下一期的实验。根据前面的数据,美国正在研制的两款疫苗宣称在三个月内能进入一期。
4、临床II期实验(有效性测试)。该阶段实验重点是证明药物对疾病治疗的有效性。被试对象一般为100到500名病人志愿者。采用随机盲测的方法,即病人志愿者被随机分配到实验组和对照组,分别给药和安慰剂,实验期满后,若能观测到实验组的治愈率显著高于对照组,则认为药物通过临床II期有效性测试。
5、临床III期实验(大规模测试)。该阶段在二期临床的基础上,进一步扩大实验的规模,以确认新药的疗效和安全性。另外,还需要为上市后大批量生产、质量监控和成本管理等商业化运作做好准备。三期实验参与测试的病人志愿者最高达到数千人。采取更加严格的双盲测,除了少数实验人员,无论是参与实验的医生,还是患者本人,都不知道服用的是新药还是安慰剂,将心理作用的影响降到最小。只有到揭盲那一天,结果才能水落石出。
一旦通过III期临床实验,获得了较全面的安全性和有效性数据,经过药监部门批准后,新药即可正式上市销售了。目前,吉利德公司研发的“瑞德西韦”正在武汉进行临床III期实验,这也是近期最有可能上市的特效药。
6、临床IV期研究 (上市后监测)。上市后,面对着更广泛的患者群体和复杂的用药环境,以及病原体可能出现变异耐药等情况,还需要对药物的疗效和安全性进行密切监测和研究。一旦发现先前实验中未发现的不良反应,或者耐药现象,则可能导致用药的调整,甚至下架召回。
以上是新药研发的标准流程,也是一个费时耗力的系统工程。相比,火神山、雷神山这样的基建项目,药物研发机构面临的情况更加复杂,主要包括以下三个方面:
1、结果的不确定性。火神山/雷神山项目,只要规划合理,资源调配得当,经过建设者们日以继夜的努力,“顺利交付”的结果基本上是可以确定的。相比之下,新药研发结果的不确定性非常高,以上六个阶段的实验流程,只要中途有一步测验没有通过(如新药的安全性或者有效性不达标),就意味着前功尽弃、推倒重来的风险。
2、道德约束。基建工程借助的是机器高强度的使用,用坏了大不了换一个。而新药研发的被试对象是患者,而且结果具有一定的不确定性,因此存在一定的道德约束。一方面,所有的新药实验都需要经过医院伦理委员会的审核、批准和监督;另一方面,试药患者的招募也必须遵循知情、自愿、允许随时退出的原则。从尊重生命的角度,道德约束是必要的,但是额外的伦理审批流程、试药患者沟通招募流程,也难免影响药物研发的效率。
3、时间约束。基建的工期是可以通过加班来压缩的,这个假期,数千万的网友通过网络直播当了一回“云监工”,见证了火神山、雷神山工地24小时昼夜不停、加班加点创造的奇迹。但新药研发是无法复制这种奇迹的,很多药物的药效和不良反应都需要经过一段时间才能反映出来,这些时间在新药研发过程中是无法压缩的。
如何从现有药物中寻找突破?
从以上介绍的新药研发流程,和受到的各种约束,可以体会到研发机构的不容易。与之矛盾的是,本次疫情拖不起,给特效药研发留的时间并不多。
当然,人们也不是束手无策,通过分析和比较本次申报的在研新药项目,可以发现两个明显的特点:
1、从现有药物中寻找突破。在当前环境下,如果从头开发一款新药,时间上很难来得及。可以观察到,当前申报的所有项目都是挖掘现有的药物和治疗方法在抗击新冠病毒方面的效果。如此,至少可以节省前期实验的时间,直接进入临床二期或三期实验,迅速投入市场。
如被寄予厚望的瑞德西韦,之前是用来防治埃博拉病毒的,已经在国外完成了一期和二期实验,并且在美国有一例成功治愈新冠肺炎患者的案例,所以这次一上来就是三期实验。2月5日,中日友好医院披露,在武汉开展瑞德西韦的临床实验,首批入组患者达到761人。
另一个比较有希望的是血浆疗法,2月13日起,相关机构号召已康复的患者捐献血浆,因为他们的血浆内含有大量的综合抗体,可以制备成特免血浆,投入重症患者的救治。有专家也指出,这个方法在抗击非典时曾用过。
期待着他们的好消息。
2、多点开花,全面覆盖。从项目数据中可以发现,参与新药的研究机构来自社会各个角落,既有钟南山院士、李兰娟院士领导的顶级科研团队,又有国际上在抗病毒方面有丰富经验的吉利德公司,还有私营的药物研发机构,以及正在抗击疫情一线的医疗机构。虽然考虑到研发结果的不确定性,没有哪个机构能够保证一定取得成功,但多点开花、全面覆盖,进一步提升成功的概率是一个不错的选择。
疫苗研发已取得初步成果
在疫苗研发方面,可能会复杂一点,主要是因为,疫苗免疫是具有特异性的——现有疫苗只能针对相应的特定病原体,对于新冠这种新病毒,需要根据流程重新开发疫苗。
早在1月28日,李兰娟院士所在的国家重点实验室宣布,已成功分离出新型冠状病毒毒株,迈出了疫苗制备重要的一步。
根据前面的数据,目前披露出来的我国疫苗项目已处于动物实验阶段。2月11日,世界卫生组织总干事谭德塞表示,新型冠状病毒疫苗有望18个月内准备就绪。相信在以中国为首的各国科研工作者的共同努力下,会取得更高的效率。
让我们敬候佳音!
-
沃尔沃并入吉利“借道”上市:吉利10年长跑终赢芳心!2020-02-21
-
吉利成功研发车规级CN95复合空调滤芯 全国车主均可免费更换2020-02-20
-
2188万起/限量130台!吉利入股路特斯后首款超跑即将交付2020-02-20
-
首席出行要闻丨传吉利欲砸3亿美元入股蔚来;新加坡计划淘汰内燃机车2020-02-19
-
吉利或将3亿美元入股蔚来,成其第三大股东2020-02-18
-
开发瑞德西韦的吉利德是一家什么公司?2020-02-17
-
十年“抱归”沃尔沃,吉利的纵横捭阖2020-02-13
-
吉利撤诉第一场诉讼,威马专利侵权案仍未了断2020-02-13
-
吉利与沃尔沃计划合并;蔚来完成1亿美元融资;特斯拉拼车业务计划上线 | 每周撩车2020-02-11
-
吉利与沃尔沃商讨合并 有望成一家超强全球车企2020-02-11
-
百尺竿头仍可再进一步,沃尔沃汽车拟与吉利汽车合并2020-02-11
-
吉利德CEO回应专利抢注:患者第一 不会陷入专利纠纷2020-02-07
-
吉利德对瑞德西韦专利纷争表态:患者第一,不希望卷入专利纷争2020-02-06
-
2019年6家自主车企销量点评,吉利136万辆夺冠,奇瑞增长12.1%!2020-01-16
-
2019年MPV总销量出炉,吉利嘉际挺进前10,比亚迪宋MAX下滑超50%2020-01-15