第一张AI影像辅助决策器械证III类证意味着什么?
第一张AI影像辅助决策器械证III类证意味着什么?12月29日,在博鳌的人工智能医疗器械创新合作平台会议之后的小型研讨会上,器审中心的一位相关人士不经意地向听者透露:“最快的话,年
12月29日,在博鳌的人工智能医疗器械创新合作平台会议之后的小型研讨会上,器审中心的一位相关人士不经意地向听者透露:“最快的话,年前会有两款人工智能产品通过审批。”离除夕还有两周时间,国家药品监督局以一纸证书证明了这一消息的真实性。
早在2018年初,人们就开始悄声争论首个医疗AI影像产品过审的时间点,2年之后,当众人对于审批已经失去耐心。这场持久的AI审批战却又突然尘埃落定,2019年1月15日,科亚医疗夺得头魁。
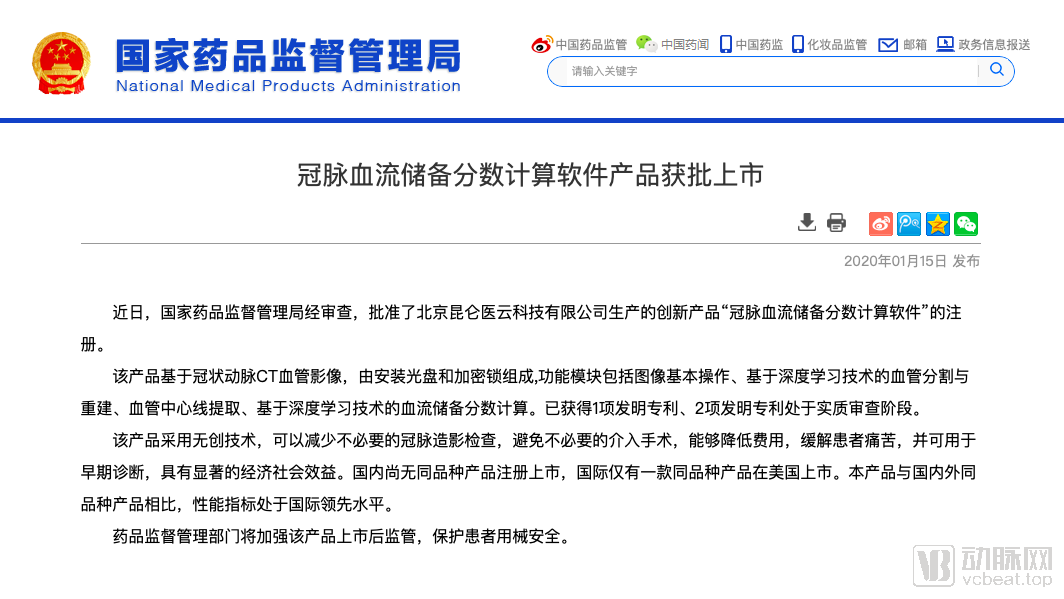
科亚医疗获得III类器械审批认证的产品名为“冠脉血流储备分数计算软件”,也就是我们常说的无创功能学分析(CT-FFR)。 它的具体原理是利用冠状动脉计算机断层扫描影像(CTA)进行CT-FFR评估,将人工智能技术的应用切入到了临床冠心病诊疗流程之中,从而提升软件处理的速度与精度。对于患者而言,该产品可通过无创的方式,减少不必要的冠脉造影检查,以避免部分介入手术,药监局以“具有显著的经济效益”九个字对产品进行了定性。
结局或许有些出人意料,首个获得AI影像III类证的产品既非公认高成熟的肺结节,也非广泛深入基层的眼底,而是入局者稀少的CT-FFR;获批形式也非众人所期望的一批产品获批,而是单个产品斩获认证。
那么,为什么科亚医疗能够在AI影像中企业的重围中“吃鸡”?动脉网采访到了科亚医疗以及多家人工智能影像企业,尝试解答以下问题:
1. 科亚医疗获得的三类证是辅助诊断影像AI三类证吗?
2. 科亚医疗为何能够拔得头筹?
3. 首个AI医疗器械审批意味着什么?
4. 接下来人工智能审批会发生怎样的变化?
科亚医疗的三类证是一张怎样的三类证?
根据国家药品监督管理局医疗器械技术审评中心描述2019年2月描述:人工智能医疗器械是指使用人工智能技术的医疗器械,包括人工智能独立软件和人工智能软件组件。人工智能技术在医疗器械的应用主要包括前处理(如成像速度提升)、流程优化(如一键操作)、常规后处理(如图像分割)、辅助决策(如辅助筛查、辅助识别、辅助诊断、辅助治疗)等方面。其中辅助决策的人工智能软件需要获得III类审批才能上市。
仔细阅读国家药品监督管理局发布软件获批消息,动脉网发现里面只有“基于深度学习技术的血管分割与重建、血管中心线提取、基于深度学习技术的血流储备分数计算”这样的字样,但没有标注证件的种类。
由于之前存在企业打擦边球的行为,即所申报的器械产品虽有深度学习算法作为辅助,但报批时并未使用“人工智能”四字作为关键点进行报批。所以,企业获得的三类医疗器械虽有深度学习、机器学习等算法助力,但仅是按正常程序通过的医疗器械产品。
为此,动脉网第一时间向器审中心相关人士求证,得到的答复是该证确为“AI三类证”,随后,科亚医疗的注册相关人员也明确告诉动脉网,该证为国内首个“人工智能医疗影像辅助决策产品”。
2019年1月16日,公众号“北京药监”发文表示,该产品为首个进入国家药品监督管理局创新医疗器械审批绿色通道并获批的人工智能医疗影像辅助决策产品,是第一个取得三类医疗器械注册证的人工智能医疗产品。
为什么是科亚医疗?
那么,CT-FFR产品为何能先于眼底、肺结节获得AI三类证审批?“创新医疗器械特别审批通道”或是原因之一。
2018年4月,科亚医疗获得获批进入“创新医疗器械特别审批通道”,成为第一个进入此通道的医疗人工智能产品。截止2019年12月,在医学人工智能领域,器审中心共收到创新医疗器械特别审查申请21项(涉及15个产品),完成17项审查,通过3项(眼科2项,心内科1项),通过率目前仅为17.6%。
按照器审中心的说法,要想成为创新医疗器械,企业产品满足知识产权、基本定型和国内首创且具有显著临床使用价值三方面要求。而当企业产品成为创新医疗器械后,能享受早期介入、专人负责、优先办理、小微企业首次注册费用减免等政策,但后续评审标准不会降低,程序不会减少。
科亚医疗的CT-FFR产品无疑满足了上述的诸多要求。
从临床上看,相关疾病患者需要先通过冠脉CTA进行初筛,排除没有冠脉狭窄的情况;接着对于初筛阳性患者进行进一步的有创ICA、FFR检查以及后续的PCI治疗。
但临床研究表明,单纯采用冠脉CTA的血管狭窄评估来进行初筛准确率并不高——有超过70%以上的初筛阳性患者实际并没有功能性缺血。对这部分人群进行后续的非必要的有创ICA、FFR检查和PCI治疗,增加了患者的医疗风险和负担,也造成了医疗资源的浪费。
无创CT-FFR基于无创的冠脉CTA图像,提升冠脉CTA对冠心病评估的准确性,以无创的方法评估狭窄是否会造成心肌缺血。科亚医疗开发的无创CT-FFR产品“深脉分数”,应用无创的CT-FFR评价指标,减少相当比例的不必要的有创冠脉造影手术和后续的PCI治疗。
科亚医疗告诉动脉网记者:“产品研发时,《深度学习辅助决策医疗器械软件审评要点》尚未发布。研发过程没有权威审评原则做指导,也没有同类产品做参考,跌撞摸索,走了一些弯路。
所幸的是,通过创新渠道沟通,“深脉分数”产品申报工作得到了主管部门的悉心指导与支持。在审评小组沟通会上,审评小组指出了产品考虑不够周全的地方。在审评中心召开的专家会上,专家对临床应用及方案提出了重要的建议。这些意见和建议对产品申报起到极大的指导和帮助作用,使产品最终能够顺利通过审批。”
进入审批绿色通道后,科亚医疗在同年8月获得欧盟CE认证,同样可能是这家企业率先获批的理由之一。
首个AI医疗器械审批意味着什么?
俗话说“抢打出头鸟”,科亚医疗此番首次获得审批,既是收获,又是风险。
先说收获,科亚医疗此次产品获批,意味着它将在细分领域的商业化尝试上先行一步,也将在短时间内收获更多资源。而对于整个行业而言,科亚的此番成功无疑为颇为冷清的医疗人工智能资本市场注入一剂强心剂,医疗人工智能辅助诊断市场有了成功商业化的可能。
再说风险,目前的医学人工智能器械审批还处于“摸着石头过河”的状态,科亚医疗虽然获得了三类器械审批,但其面临的必然是极其严格的上市后监管,但这也能推动科亚医疗更好的完善他们的产品。
部分头部AI影像企业告诉动脉网:从今年的形式看,其他医疗人工智能影响产品获批也已是大概率事件,只要企业对自己的产品有信心,并不需要抢夺AI医疗领域第一,只需拿到细分领域第一即可。
接下来人工智能审批会发生怎样的变化?
现有的人工智能器械审批的相关政策主要为《深度学习辅助决策医疗器械软件审评要点》、《医疗器械生产质量管理规范附录独立软件》,仍在起草、计划在2020年发布的文件包括《医疗器械生产质量管理规范独立软件现场检查指导原则》、《医疗器械人因设计注册技术审查指导原则》。
此外,冠脉CTA、脑MRI、心脏MRI、心电等测试数据库仍在建设之中,所以即便是科亚医疗已经过审的产品,也将面临进一步的监管挑战。
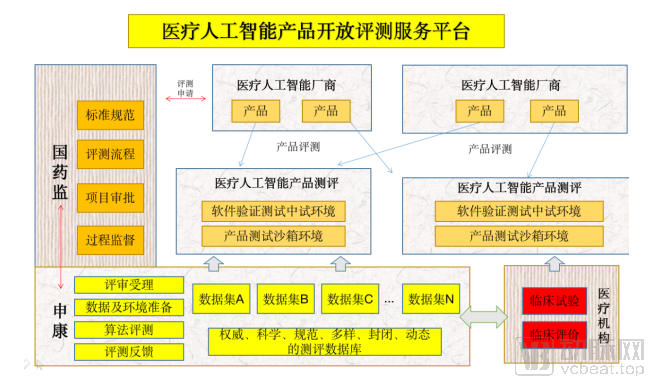
在网络安全方面,医疗人工智能软件的介入必然设计诸多数据传输环节。但就现在审批所使用的网络法规仍有待完善。具体而言,人工智能医疗器械创新合作平台网络安全工作组将在2020年开展人工智能医学软件网络安全漏洞共享平台建设研究、人工智能医学软件网络安全检定规范研究;针对于人工智能医疗器械的网络安全测试体系研究,如保密性测试、完整性测试、可得性测试、审计功能测试等将在2020年陆续完善。
未来,医疗器械的真实世界研究也在规划之中,在2020年的工作之中,真实世界数据应用工作组会更加关注AI产品的临床试验与医学伦理审批。在这一前提下,美国FDA与欧盟CE的审批经验将变得额外重要,布局海外的人工智能企业在推进审批中能获得重要的优势,海外的人工智能企业也许能通过这样的方式进入中国。或许,在不远的将来,AI器械能够像药物那样通过RWS获得审批认证。
总的来说,现在仍有待加强的规范重点主要政策规范、测评数据库的建立与网络安全研究推进;当然今年上市的人工智能产品必将经历严格的上市后监管,具体情况还需要时间给出答案。
我们还能期待什么?
回到最开始,器审中心的相关人士提到的是“两款”医疗人工智能产品获得审批。而据动脉网了解,某专注于心脑血管类AI的创业公司已经获得相关消息,那么在年后,第二张AI辅助诊断三类证也将来临。
随着两个人工智能产品“持证上岗”,肺结节、眼底等等产品的审批不过只是时间问题。在新的一年中,人工智能无疑会进入真正的“商业化”阶段,“落地”这个模凌两可的词,也将逐渐退出历史舞台。
但还是那句话,“三类证只是打开了人工智能商业化的大门”,或许到了这个时候,真正的厮杀才刚刚开始,谁胜谁负,也将逐一揭晓答案。
而对于医院、对于医生、对于患者,商业化的推进将伴随临床实验法规的完善、测评数据库的完善、网络安全法规的完善……我们正向着一个更加高效、更加安全、更加规范的世界走去。
作者:赵泓维
-
韩国科技部启动《人工智能国家战略》2020-01-17
-
据传国内首个AI三类医疗器械面世,与人工智能有关?2020-01-16
-
中美经贸协议中有哪些医疗相关内容2020-01-16
-
苹果发力人工智能:2亿美元收初创公司Xnor.ai2020-01-16
-
据传国内首个AI三类医疗器械面世,真的与人工智能有关吗?2020-01-16
-
旺龙云电梯助力科技“航母”—商汤人工智能大厦进入AI乘梯时代2020-01-16
-
国内首个!科亚医疗人工智能医学影像产品获批,“深脉分数”持证上岗!2020-01-16
-
国产人工智能机器人辅助全髋置换成功2020-01-16
-
提起人工智能只能想到北上深?40家江苏AI企业盘点2020-01-16
-
首个以“深度学习”命名的三类器械审批证批出2020-01-16
-
强生视力健、美敦力主动召回这两种医疗器械,为何?2020-01-15
-
算法可检测生命体征,远程医疗即将来临?2020-01-15
-
2019医疗领域十大关键词2020-01-15
-
盘点2019医疗行业十大超级企业2020-01-15
-
人工智能公司Nference完成6000万美元B轮融资,以开发其基因数据深度学习平台2020-01-15