HNF4调节脂肪酸氧化,是小鼠肠道干细胞更新所必需的
HNF4调节脂肪酸氧化,是小鼠肠道干细胞更新所必需的文章背景简介肠上皮细胞具有自我更新和产生分化细胞的能力,每3-5天发生一次更替,这种更替是被活跃的循环干细胞群(其特征是具有Lg
文章背景简介
肠上皮细胞具有自我更新和产生分化细胞的能力,每3-5天发生一次更替,这种更替是被活跃的循环干细胞群(其特征是具有Lgr5表达)所推动的。肠道干细胞(又称为Lgr5+隐窝基底柱状细胞或ISCs)及其增殖后代被嵌套在称为隐窝的杯状结构中,而管腔投射状的绒毛完全由分化细胞组成。
营养调节和代谢控制在干细胞生物学中具有重要的作用。研究表明,肠道干细胞(ISCs)对热量限制和包括脂肪酸、葡萄糖、N-乙酰-D-葡萄糖胺和氨基酸在内的膳食营养素有反应。此前研究表明,LGR5+细胞特别依赖于线粒体代谢。在ISCs中,脂肪酸氧化能够刺激氧化磷酸化。这些研究表明,细胞代谢是肠道干细胞稳态的基础调节因子。然而,目前尚不清楚肠道干细胞独特的代谢状态是如何建立的。
由于脂肪酸β-氧化(FAO)是多种组织中干细胞维持的关键,因此了解ISCs通过FAO实现自我更新的调节机制是有必要的。肝细胞核因子4(HNF4)有一个保守的配体结合区,能够与脂肪酸组成性结合在一起。HNF4A是代谢稳态的重要调节因子,参与肝脏脂质代谢基因的转录。与酰基-CoA代谢相关的基因被确定为是HNF4A的靶点,HNF4A能够结合酰基-CoA结合蛋白和脂酰-CoA硫酯。
肠道干细胞与肠道疾病和癌症相关。了解肠道干细胞(ISC)生理调控机制对人类健康和再生医学具有重要意义。然而,调控ISC代谢的机制尚不清楚。基于FAO在干细胞维持中的潜在作用以及HNF4在调节脂质代谢过程中的重要性,美国罗格斯大学新泽西人类遗传学研究所、美国新不伦瑞克新泽西州罗格斯癌症研究所的Lei Chen, Roshan P. Vasoya, Natalie H. Toke等人研究了HNF4转录因子是如何影响ISC代谢,以及HNF4依赖性的代谢调节是否是维持ISC所必需的。该研究于2019年以“HNF4 Regulates Fatty Acid Oxidation and is Required for Renewal of Intestinal Stem Cells in Mice”为题发表在《Gastroenterology》杂志上(IF2018=19.233,医学1区)。
所用到的主要方法
1.肠上皮、绒毛和隐窝细胞分离
2.组织学和免疫染色
3. qRT-PCR
4. Western blot
5.类器官培养、计数、免疫荧光
6.FAO活性检测
7.LC-MS分析
文章主要内容摘要
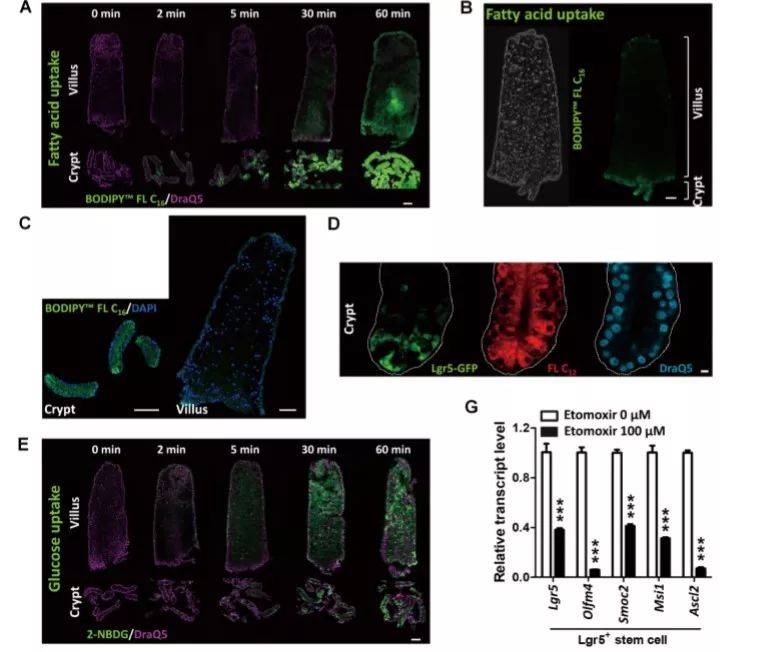
肠道干细胞(ISCs)的功能受饮食和代谢途径的调节。肝细胞核因子4(HNF4)是结合脂肪酸的转录因子。作者选用Villin-CreERT2、Lgr5-EGFP-IRES-CreERT2、Hnf4af/f和Hnf4gCrispr/Crispr小鼠研究了HNF4转录因子的代谢调节机制及在小鼠ISCs中的功能。作者从肠道分离隐窝和绒毛细胞,用带荧光标记的脂肪酸或葡萄糖类似物孵育,然后通过共聚焦显微镜观察。检测Hnf4agDKO和对照小鼠近端小肠收集的细胞中脂肪酸氧化活性和三羧酸循环(TCA)代谢产物。此外,作者进行了染色质免疫沉淀和基因表达谱分析,以确定受HNF4因子调控的基因;从十二指肠隐窝提取类器官,用标记的棕榈酸酯或乙酸酯孵育,检测TCA代谢产物或脂肪酸的产生;还通过乙酸或二氯乙酸进行了代谢干预。
研究结果表明,隐窝细胞能够迅速吸收带标记的脂肪酸,在用FAO(脂肪酸β氧化)抑制剂Etomoxir孵育的类器官中,LGR5+干细胞标志物(Lgr5、Olfm4、Smoc2、Msi1和Ascl2)的mRNA水平被下调,表明FAO是ISCs更新所必需的。HNF4A和HNF4G在ISCs和整个肠上皮中均有表达。HNF4A和HNF4G的单基因敲除不影响ISCs的维持,但双基因敲除会导致ISC丢失,致使干细胞不能再生。FAO支持ISC更新,HNF4转录因子直接激活Acsl5和Acsf2(编码长链脂酰CoA合成酶)、Slc27a2(编码脂肪酸转运蛋白)、Fabp2(编码脂肪酸结合蛋白2)和Hadh(编码羟基-CoA脱氢酶)等FAO基因。与对照小鼠相比,Hnf4agDKO小鼠肠上皮FAO基因表达水平、FAO活性和TCA代谢产物均显著降低,但脂肪酸合成转录产物增加。从双基因敲除小鼠肠道分离的隐窝与乙酸或二氯乙酸共培养能够恢复肠道干细胞。综合而言,在小鼠中,转录因子HNF4A和HNF4G会调节脂肪酸氧化所需基因的表达,这是肠干细胞更新所必需的。
-
自噬诱导KDR/VEGFR-2激活,促进胶质瘤干细胞血管生成拟态形成2019-12-19
-
造血干细胞只是开端 新的干细胞时代正到来2019-11-26
-
永生之门——哪里是中国干细胞技术的创新尖峰?2019-11-20
-
科学家用生物3D打印技术为干细胞工程提供细菌负载微凝胶2019-07-10
-
权威期刊公布试验进展:干细胞移植可能“治愈”第二名HIV患者2019-06-04