SMYD3催化的MAP3K2赖氨酸甲基化与Ras致癌作用有关
SMYD3催化的MAP3K2赖氨酸甲基化与Ras致癌作用有关文章背景简介Ras是一种原癌基因,可引起大部分癌症的发生。胰腺导管腺癌(PDAC)就是一种由致癌基因Ras突变引起的癌症
文章背景简介
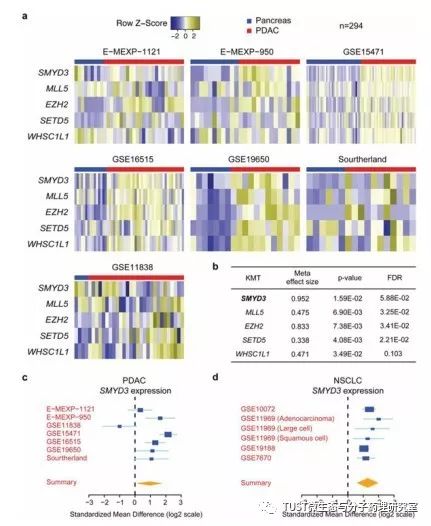
Ras是一种原癌基因,可引起大部分癌症的发生。胰腺导管腺癌(PDAC)就是一种由致癌基因Ras突变引起的癌症,对54个人类KMT(赖氨酸甲基转移酶)基因在PDAC中表达水平的分析显示:SMYD3与PDAC的相关性最为显著,在一些Ras活性升高的癌症中,SMYD3表达量增加,并且SMYD3蛋白的表达量随着PDAC肿瘤的发展而增加。
PDAC产生于Ras信号激活后腺泡细胞分化为导管样细胞的过程中。在此过程中,SMYD3可诱导胰腺特异性激活K-Ras的肿瘤。SMYD3是腺泡细胞形成导管所必需的。Ras通路的激活经常发生在肺腺癌中,肺腺癌也是一种高SMYD3表达的癌症。在成年Kras+/LSL-G12D小鼠气管内注射一种表达Cre重组酶(Ad-Cre)的腺病毒,导致在12周内出现非典型腺瘤性增生(AAH)和肺腺瘤,相比之下,在Ad-Cre感染后16周、20周或更长时间,缺乏SMYD3的小鼠比对照组小鼠产生明显更小和更少的晚期肿瘤,表明SMYD3的缺失阻碍了从腺瘤到腺癌的关键转变。通过后续实验,证明SMYD3的靶点为MAP激酶途径的MAP3K2。细胞质激酶MAP3K2会在多种应激和有丝分裂刺激下被激活,并将信号传递给下游的MAP激酶成员(如ERK1/2和ERK5)。当EGF用于激活人肺癌和胰腺癌细胞中的ERK1/2时也需要SMYD3的参与。
小剂量使用MEK1/2抑制剂曲美替尼会抑制Kras突变小鼠的pERK1/2水平和肿瘤病变的形成,足以阻断SMYD3基因敲除后的肿瘤发生和ERK1/2磷酸化激活,表明SMYD3在肿瘤发生中可能与MEK1/2信号通路存在协同作用。
Pawel K. Mazur 等人,于2014年6月在《Nature》(IF=15.21,综合性期刊 1区)发表,题为“SMYD3 links lysine methylation of MAP3K2 to Ras-driven cancer ”。本篇文章主要以Ras信号激活的癌症为主要实验对象,研究了SMYD3及MAP信号中主要成员MEK1/2和ERK1/2之间的关系。SMYD3可以使MAP3K2甲基化,MAP3K2的SMYD3甲基化与ERK1/2的磷酸化并无直接关系,以及PP2A的积累负反馈调节癌症进程。
所用到的主要方法
(1)建立胰腺癌小鼠模型
(2)胰腺上皮组织块的免疫荧光
(3)免疫组化
(4)免疫印迹分析
(5)癌细胞异种移植
文章主要内容摘要
赖氨酸甲基化信号的解除已成为调控癌症发病机制中的一个常见病因,一些组蛋白赖氨酸甲基转移酶(KMTs)的抑制剂正被开发为化疗制剂。大量细胞质甲基转移酶,如SMYD3(SET和MYND结构域蛋白3),在许多人类肿瘤中过度表达。然而,SMYD3调节肿瘤途径的分子机制及其与体内肿瘤发生的关系还不清楚。
本文发现SMYD3可以使MAP3K2甲基化而后增加了MAP激酶信号传导,促进Ras驱动的癌变形成。利用小鼠胰腺导管腺癌(PDAC)和肺腺癌(LAC)模型,分析表明降低SMYD3的催化活性可以抑制Ras信号途经并降低肿瘤的发生。
本研究利用蛋白质阵列技术鉴定出MAP3K2激酶是SMYD3作用的唯一靶点。在癌细胞系中,SMYD3介导的MAP3K2赖氨酸260处甲基化增强了Ras/Raf/MEK/ERK信号传导。MAP激酶途径的关键负调控因子PP2A磷酸酶复合物可与MAP3K2结合,这种蛋白间的相互作用会被甲基化所阻断。本文结果阐释了赖氨酸甲基化在癌细胞细胞质激酶信号级联中的新作用,并确定了SMYD3在调节致癌Ras信号中会起到关键作用。
-
Cell Metab:丙酮酸激酶可代谢反馈式调控细胞呼吸中的氧化还原能力2019-06-04